QUÍMICA DE EXAMEN ADMISIÓN RESUELTO PDF
PREGUNTA 1:
Se desea estudiar una muestra de agua oxigenada comercial, para lo cual debemos determinar su porcentaje de agua, su estabilidad o velocidad de descomposición y su acción curativa frente a una infección. ¿Qué ramas de la química intervienen en este estudio?.
A) Inorgánica – orgánica – analítica.
B) Analítica – orgánica – bioquímica.
C) Inorgánica – fisicoquímica – fisicoquímico.
D) Analítica – fisicoquímica – bioquímica.
E) Fisicoquímica – analítica – ambiental.
RESOLUCIÓN :
Analítica: analiza una muestra, determinando su composición.
Fisicoquímica: La velocidad de una reacción es estudiada por la cinética química que esta dentro de la fisicoquímica.
Bioquímica: estudia las reacciones en el organismo y relacionadas con la vida.
Rpta.: "D"
PREGUNTA 2:
El núcleo de un átomo puede contener :
A) Neutrones y protones.
B) Neutrones y electrones.
C) Solamente electrones.
D) Neutrones, protones y electrones.
E) Protones y electrones.
RESOLUCIÓN :
El núcleo de un átomo puede contener neutrones y protones, concentrado prácticamente la masa del átomo.
Rpta.: "A"
PREGUNTA 3:
El electrón de un átomo hidrogeno :
A) Es idéntico a un electrón del átomo de oxígeno.
B) Tiene mayor masa que el electrón del átomo del oxígeno.
C) Es más grande que el electrón del átomo de oxígeno.
D) Tiene mayor carga que el electrón del átomo de oxígeno.
E) Puede tener mayor o menor carga que el electrón del átomo de oxígeno, dependiendo de las circunstancias.
RESOLUCIÓN :
El electrón es una partícula subatómica con propiedades características, que contribuye a la estructura de los átomos. El número de electrones del átomo de un elemento es diferente al del átomo de otro elemento. Un electrón del átomo de un elemento es idéntico al del átomo de otro elemento.
Rpta.: "A"
PREGUNTA 4:
Cuando se realiza un trabajo científico, se formulan algunos problemas acerca de la naturaleza. Esto nos lleva a plantear la _______ , es decir, una respuesta posible a la pregunta planteada tras la observación.
A) conclusión
B) ley
C) experimentación
D) hipótesis
E) teoría
RESOLUCIÓN :
El método científico permite hallar respuestas a las interrogantes sobre la naturaleza. Es una serie de procesos que se caracterizan por ser planificados, organizados y ordenados. El método científico consta de los siguientes pasos :
I) Observación: Debe ser exacta y contar con un registro. Esta información constituye la matriz de datos para un posterior experimento. Es importante resaltar que las opiniones y emociones del científico no influyan en este paso.
II) Hipótesis : Es una posible respuesta a una pregunta acerca de un fenómeno observado en la naturaleza.
III) Experimentación : Es la prueba científica de la hipótesis. El científico diseña un experimento para comprobar la hipótesis planteada. El experimento incluye un grupo control y un grupo experimental.
IV) Resultados : Se obtienen después de realizar el experimento. Los resultados también deben estar bien registrados.
V) Conclusiones: Permite verificar o confirmar la hipótesis planteada. Las conclusiones pueden formar teorías o leyes.
Rpta.: "D"
PREGUNTA 5:
La expresión:
“En toda reacción química hay transformación de sustancias”
corresponde a una:
A) Hipótesis
B) Observación
C) Experimentación
D) Teoría
E) Ley
RESOLUCIÓN :
La expresión corresponde a la ley de conservación de la materia expresada a través de la ley de Lavoisier, en la cual en una reacción química se generan nuevas sustancias sin embargo la masa de los reactantes es igual a la masa de los productos.
Rpta.: "E"
PREGUNTA 6:
Cuáles de los siguientes fenómenos son cambios químicos
1) Condensación
2) Corrosión
3) Recalentamiento gaseoso
4) Combustión
5) Fermentación
A) 1, 2, 3
B) 1, 3, 5
C) 2, 3, 4
D) 3, 4, 5
E) 2, 4, 5
RESOLUCIÓN :
Los fenómenos químicos son aquellos que modifican la composición de la materia obteniéndose sustancias nuevas. Como ejemplo de estos fenómenos tenemos la corrosión, la combustión y la fermentación.
Rpta.: "E"
PREGUNTA 7:
De las expresiones mencionadas, ¿Cuál representa la unidad de medida de la densidad?
I) kg/dm³
II) g/ml
III) g/cm³
A) Solo I
B) Solo III
C) Solo I y II
D) Solo II y III
E) I, II y III
RESOLUCIÓN :
La densidad es unidad de masa/unidad de volumen , en el sistema métrico la unidad de masa puede ser: kilogramo o gramo. El volumen, en el mismo sistema, puede ser: centímetro cúbico, decímetro cúbico, mililitro.
Rpta.: "E"
PREGUNTA 8:
Identifique el caso que corresponde a una sustancia elemental.
A) diamante
B) agua de mar
C) bronce
D) cemento
E) ácido muriático
RESOLUCIÓN :
Una sustancia simple o elemental es aquella que está formada por una sola clase de átomos. El oxígeno normal (O2) y el ozono (O3) son sustancias elementales, ya que sus moléculas están formadas solo por átomos de oxígeno.
Analizando cada alternativa :
A) Diamante: Forma alotrópica del carbono (sustancia elemental).
B) Agua de mar: Solución acuosa en la que se encuentran disueltas sales, gases, etc.
C) Bronce: Solución formada principalmente por cobre y estaño.
D) Cemento: Mezcla de arcilla molida y materiales calcáreos en polvo que en contacto con el agua se endurece.
E) Ácido muriático: Solución acuosa de cloruro de hidrógeno.
Rpta.: "A"
PREGUNTA 9:
Dadas las siguientes proposiciones referidas a la composición de la materia:
I) La gasolina es un compuesto formado por carbono , hidrógeno y oxígeno.
II) El granito es una mezcla heterogénea.
III) El ozono es una mezcla homogénea de átomos y moléculas de oxígeno.
Son correctas:
A) Solo I
B) Solo II
C) Solo III
D) I y II
E) II y III
RESOLUCIÓN :
I) INCORRECTA :
La gasolina no es un compuesto químico , sino una mezcla de hidrocarburos líquidos derivados del petróleo.
II) CORRECTA :
El granito es una roca conformada por una mezcla heterogénea de ciertos minerales como: cuarzo , feldespatos , mica , etc.
III) INCORRECTA :
El ozono , O3 no es una mezcla , es una sustancia simple.
Rpta.: "B"
PREGUNTA 10:
Sobre la base de los siguientes estudios realizados, ¿cuál de las siguientes proposiciones responde a una ley científica?
A) La relatividad de Einstein.
B) La extinción de los dinosaurios.
C) La evolución de Darwin.
D) El Big Bang.
E) La gravitación universal.
RESOLUCIÓN :
La gravitación universal responde a una ley científica: “la fuerza de atracción que experimentan dos cuerpos dotados de masa es directamente proporcional al producto de sus masas e inversamente proporcional al cuadrado de la distancia que los separa”. Las demás proposiciones responden a teorías.
Rpta.: "E"
PREGUNTA 11:
Según el modelo atómico de Thomson no se cumple
A) El átomo se asemeja a un «Budín con pasas»
B) Determina la relación carga - masa del electrón
C) El átomo es de naturaleza positiva y lleva incrustados a los electrones.
D) Eléctricamente el átomo es neutro .
E) El átomo posee un núcleo cargado positivamente , rodeado de cargas negativas.
RESOLUCIÓN :
No se cumple la proposición E , porque en el modelo atómico de Thomson , no se plantea la presencia de un núcleo .
Rpta.: "E"
PREGUNTA 12:
Señale cuál de las siguientes opciones no es una mezcla.
A) aire
B) agua de mesa
C) nube
D) mayonesa
E) ozono
RESOLUCIÓN :
El ozono no es una mezcla, es un compuesto químico, es una molécula que está constituida por la unión química de 3 átomos de oxígeno.
Las demás opciones a, b, c, d son mezclas.
Rpta. : "E"
PREGUNTA 13:
Ernest Rutherford describe el átomo como si fuera
A) una esfera compacta.
B) un budín de pasas.
C) un sistema solar.
D) un sistema esférico con niveles estacionario.
E) una nube esférica.
RESOLUCIÓN :
Ernest Rutherford consideró que el átomo en su mayor parte presenta espacio vacío, presenta un núcleo central alrededor del cual gira los electrones de carga negativa comparándolo a un sistema solar.
En cambio las respuestas:
a) Pertenece a J.Dalton
b) Pertenece a J. Thomson
d) Pertenece a Niels Bohr
e) Pertenece a Schrödinger.
Rpta. : "C"
PREGUNTA 14:
Identifique la acción en la que se producen cambios químicos:
I) doblar un alambre por calentamiento
II) descomponer el agua por acción de la corriente eléctrica
III) hervir agua mediante paneles solares
IV) hacer que se oxide un clavo de hierro
A) I solamente
B) I y II
C) III solamente
D) II y IV
E) IV solamente
RESOLUCIÓN :
II Y IV son acciones que producen cambios químicos, quiere decir que al producirse varía su estructura química, produciéndose nuevas sustancias.
En cambio I y III la sustancia solo sufre cambio físico sin comprometer su estructura química.
Rpta. : "D"
PREGUNTA 15:
De la experiencia de Rutherford se dedujo lo siguiente:
A) La mayor parte del átomo es espacio vacío, el núcleo debía ser muy pequeño y de carga positiva, alrededor del núcleo giran los electrones.
B) La mayor parte del átomo concentra a los electrones, el núcleo puede ser excéntrico y contiene neutrones, los electrones forman una nube.
C) Los átomos parecen un budín de pasas, con núcleo central y una nube conteniendo los electrones.
D) Los átomos tienen un núcleo central, los electrones giran alrededor de él y al ganar energía pueden pasar de un nivel a otro.
E) Los átomos son esferas compactas de diverso tamaño según el elemento, indivisibles y con una nube electrónica.
RESOLUCIÓN :
En 1909 Rutherford dirigió un experimento conocido como “Experimento de la laminilla de oro” en que dedujo que: La mayor parte del átomo es espacio vacío, el núcleo debía ser muy pequeño y de carga positiva, alrededor del núcleo giran los electrones.
Rpta. : "A"
PREGUNTA 16:
Los núclidos
son
A) Isótopos
B) Isómeros
C) Isóbaros
D) Isótonos
E) Isócoros
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 17:
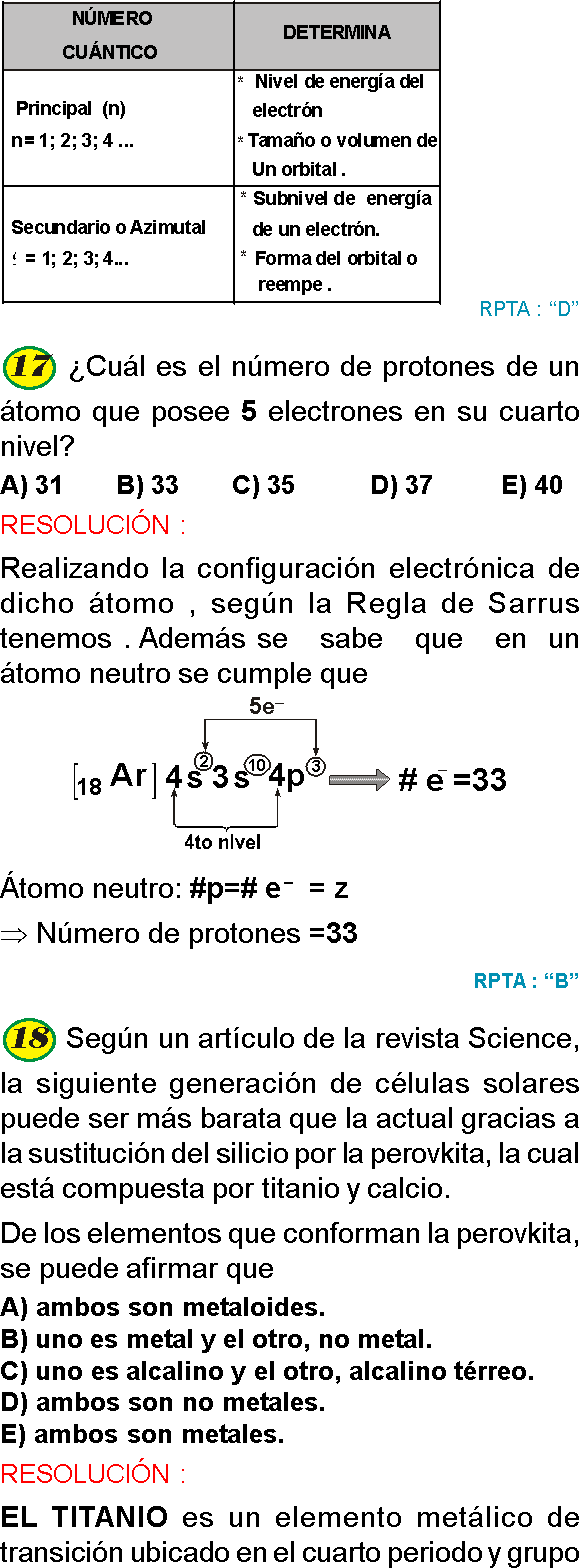
Si el número de masa de un átomo es el triple de diez más uno y en su tercer nivel de energía presenta 5 electrones, ¿cuántos neutrones presentará el átomo?
A) 16
B) 31
C) 15
D) 5
E) 14
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 18:
Con respecto a la tabla periódica, ¿cuál de los siguientes elementos no pertenece a la familia de los elementos indicados?
A) Sodio (Na) metal alcalino
B) Estroncio (Sr) metal alcalino térreo
C) Xenón (Xe) gas noble.
D) Bario (Ba) metal alcalino térreo.
E) Iridio (Ir) gas noble.
RESOLUCIÓN :
Los gases nobles (VIIIA) están conformados por los elementos He, Ne, Ar, Kr, Xe, Rn; luego la clave incorrecta sería que el Iridio sea gas noble, pues se trata de un elemento de transición con Z=57.
Rpta. : "D"
PREGUNTA 19:
Determine el número de oxígeno que contiene el permanganato de calcio:
A) 4
B) 2
C) 3
D) 8
E) 6
RESOLUCIÓN :
El permanganato de calcio tiene como fórmula: 𝐶𝑎(𝑀𝑛𝑂4)2 De esta fórmula nos percatamos que dicha sustancia posee 8 oxígenos.
Rpta. : "D"
PREGUNTA 20:
Los jabones son compuestos que se forman a partir de los ácidos grasos que provienen de los lípidos, químicamente pertenecen a la función:
A) Éster
B) Sal
C) Amida
D) Alcohol
E) Cera
RESOLUCIÓN :
Los jabones son “sales” (generalmente de sodio y potasio) obtenidos de la reacción de un lípido y una base; dicha reacción se denomina saponificación.
Rpta. : "B"
PREGUNTA 21:
Determine el período y el grupo al cual pertenece un átomo cuyo número atómico es 6.
A) 2, (VIII A)
B) 2, (IV A)
C) 3, (III A)
D) 3, (IV B)
E) 2, (II A)
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 22:
Cuatro litros de un gas están a 600 mmHg de presión. ¿Cuál será su nuevo volumen sí aumentamos la presión hasta 800 mmHg?
A) 1 L
B) 2 L
C) 2,5 L
D) 3 L
E) 1,5 L
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 23:
En relación a los recursos naturales y la industria química se puede afirmar que:
( ) Cuando los detergentes son utilizados en gran cantidad, en la industria y en el hogar, son fuente de contaminación del agua.
( ) El formaldehído usado ampliamente en la fabricación de madera prensada y enchapada tiene efectos carcinógenos.
( ) El 𝐶𝑂2 emitido por la quema de combustibles fósiles es el principal gas que intensifica el efecto invernadero.
A) VFV
B) FVV
C) VVV
D) FVF
E) VVF
RESOLUCIÓN :
(V) Debido a la gran cantidad de fosfatos y sulfatos presentes en los detergentes estos contaminan las aguas induciéndolas a una eutrofización.
(V) Los productos de madera prensada contienen formaldehído (considerado como cancerígeno por la OMS) el cual se va evaporando poco a poco al interior de las casas.
(V) El 𝐶𝑂2(g) es el principal gas causante del efecto invernadero, una de sus fuentes de origen es la quema de combustibles fósiles.
Rpta. : "C"
PREGUNTA 24:
El yodo radiactivo (I-131) se emplea en:
A) Obstrucciones de la sangre.
B) Cáncer a la piel.
C) Tratamiento de la tiroides.
D) Matar gusanos.
E) Bailar mejor
RESOLUCIÓN :
El yodo radioactivo (I−131) se emplea para el tratamiento de la glándula tiroides.
Rpta. : "C"
PREGUNTA 25:
No corresponde a su nombre químico:
A) H3PO4 : Ácido fosfórico
B) Na2O2: Peróxido de sodio
C) AgCℓ: Cloruro de plata
D) HCℓ: Ácido hipocloroso
E) NaNO2: Nitrato de sodio
RESOLUCIÓN :
HCℓ: Cloruro de hidrógeno o Ácido Clorhídrico (ácido HIDRÁCIDO)
La nomenclatura HIPO y OSO es utilizada para ácidos OXÁCIDOS
Rpta.: "D"
PREGUNTA 26:
Según un artículo de la revista Science, la siguiente generación de células solares puede ser más barata que la actual gracias a la sustitución del silicio por la perovkita, la cual está compuesta por titanio y calcio. De los elementos que conforman la perovkita, se puede afirmar que
A) ambos son metaloides.
B) uno es metal y el otro, no metal.
C) uno es alcalino y el otro, alcalino térreo.
D) ambos son no metales.
E) ambos son metales.
RESOLUCIÓN :
El titanio es un elemento metálico de transición ubicado en el cuarto periodo y grupo IVB, se caracteriza por su alta dureza, inoxidabilidad y ser muy ligero.
El calcio es un elemento muy metálico del tipo representativo, ubicado en el cuarto periodo y grupo IIA, familia de los alcalinotérreos. Reacciona fácilmente con el O2(g) y el H2O.
Rpta.: "E"
PREGUNTA 27:
La destrucción de la capa de ozono se produce por acumulación de
A) CFC
B) O3
C) CO2
D) CO
E) H2O
RESOLUCIÓN :
Dentro de los gases que evitan la formación de la capa de ozono en mayor proporción son los CFC (grupo de compuestos que contienen cloro, flúor y carbón) que están presentes en diversos equipos y en materiales de limpieza.
Rpta. : "A"
PREGUNTA 28:
En los ecosistemas, los animales que se alimentan solo de vegetales se llaman
A) omnívoros.
B) fitófagos.
C) quimio sintetizadores.
D) carroñeros.
E) coprófagos.
Rpta. : "B"
PREGUNTA 29:
El efecto invernadero es un proceso de cambios químicos de la atmósfera generados por causas antrópicas. Está asociado a la acumulación de gases en la atmósfera, donde la mayor proporción lo origina el
A) CH4
B) SO2
C) NO2
D) CO2
E) H2O
RESOLUCIÓN :
El 𝐶𝑂2 es el gas que mayor impacta por su proporcionalidad dentro de los gases efecto invernadero proveniente de la industrialización y parque automotor.
Rpta. : "D"
PREGUNTA 30:
¿En qué grupo existe un elemento extraño?
A) Cl, Br, I
B) He, Ra, Ar
C) Li, Na , K
D) Au, Ag, Cu
E) Be, Mg, Ca
Rpta.: "B"
PREGUNTA 31:
Tendiendo en cuenta la tabla periódica de los elementos, ¿Cuál de las siguientes proposiciones es correcta, con respecto a la variación de los radios atómicos?.
A) En un mismo período se mantienen constantes.
B) En un mismo grupo aumentan de abajo hacia arriba.
C) En un mismo período decrecen de izquierda a derecha.
D) En un mismo período aumenta con el número atómico.
E) En un mismo grupo decrecen con el incremento del número de protones.
RESOLUCIÓN :
El radio atómico es la distancia de separación entre el núcleo atómico y la capa de valencia (último nivel energético).
El radio atómico en el grupo aumenta con el número atómico .
El radio atómico en el período disminuye de izquierda a derecha.
Rpta.: "C"
PREGUNTA 32:
Los tres factores más importantes en el aumento de la velocidad de las reacciones químicas son :
A) Temperatura, viscosidad, densidad.
B) Presión , volumen , catalizador.
C) Tensión superficial , presión , catalizador.
D) Temperatura, densidad , concentración.
E) Concentración, temperatura , catalizador.
RESOLUCIÓN :
La velocidad de reacción es la cantidad de reactivo que se combina en la unidad de tiempo .
En la velocidad influye los siguientes factores : Naturaleza de los reactivos , temperatura, concentración de los reactivos , catalizador y estado de división .
Luego los tres factores más importantes en el aumento de la velocidad de reacción son : concentración , temperatura y catalizador.
Rpta.: "E"
PREGUNTA 33:
Son características de las bases:
I) Tienen sabor agrio
II) Tienen sabor amargo
III) Reaccionan vigorosamente con los metales activos liberando hidrógeno gaseoso
IV) Al tacto son de consistencia jabonosa
V) Neutralizan a los ácidos
A) I, IV y V
B) II, IV y V
C) I, II y III
D) II, III y IV
E) III, IV y V
RESOLUCIÓN :
Las bases a diferencia de los ácidos tienen sabor amargo, al tacto son de consistencia jabonosa y neutralizan a los ácidos.
Rpta.: "B"
PREGUNTA 34:
Indicar lo que no corresponde :
I) El carbono se halla en forma cristalina , amorfa y alotrópica .
II) El diamante es la sustancia natural más pura.
III) El coke se obtiene como resultado del tratamiento del petróleo.
A) VVV
B) VFV
C) FVF
D) FVV
E) FFF
RESOLUCIÓN :
I) VERDADERO : Existen carbonos cristalinos , y amorfos .
II) VERDADERO : El diamante es una forma alotrópica del carbón de alta pureza .
III) VERDADERO: Al someter a un proceso de destilación fraccionada al petróleo se obtiene un residuo sólido que contiene coke.
Rpta.: "A"
PREGUNTA 35:
El gas natural consiste principalmente en una mezcla de :
A) Metano y vapor de agua .
B) Oxígeno, metano e hidrógeno .
C) Propano y ciclohexano .
D) Benceno, hidrógeno y vapor de agua .
E) Metano, etano, propano y butano .
RESOLUCIÓN :
El gas natural se obtiene en las perforaciones de yacimientos petrolíficos, sale juntos con el petróleo crudo. Se trata de mezcla de gases de la serie parafínica: Metano (CH4); Etano (C2H6); Propano (C3H8) y Butano (C4H10). El gas natural se emplea como combustible y materia prima de la industria petroquímica.
Luego el gas natural es una mezcla de : Metano, Etano, Propano y Butano .
Rpta.: "E"
PREGUNTA 36:
El proceso de cracking del petróleo consiste en :
A) La polimerización de las fracciones ligeras del petróleo.
B) La pirólisis de hidrocarburos de elevada masa molecular.
C) La separación del gas natural disuelto en el petróleo.
D) La destilación fraccionada de los hidrocarburos livianos.
E) La eliminación de compuestos sulfurados disueltos en el petróleo.
RESOLUCIÓN :
La gasolina es uno de los productos del petróleo de mayor consumo , razón por la cual se ha diseñado el proceso de cracking , el cual consiste en el rompimiento de moléculas de hidrocarburos de alta masa molecular, obteniéndose moléculas de hidrocarburos de baja masa molecular, mediante el calor (600°C) y la presión (5 ATM).
Rpta.: "B"
PREGUNTA 37:
El incremento de dióxido de carbono en la atmósfera causa un fenómeno llamado
A) helada
B) lluvia ácida
C) smog
D) inundación
E) efecto invernadero
RESOLUCIÓN :
El incremento de dióxido de carbono es uno de los fenomenos causantes del efecto invernadero el cual es el calentamiento natural de la Tierra. Los gases de efecto invernadero como el CO2, CH4, H2O, entre otros, presentes en la atmósfera, retienen la radiación infrarroja que emana la Tierra y mantienen una temperatura apta para la vida. La quema de combustible o la deforestación incrementan la cantidad de gases invernaderos, principalmente el CO2. La atmósfera modificada retiene más calor, daña el equilibrio natural y aumenta la temperatura de la Tierra, lo que provoca el calentamiento global.
Rpta.: "E"
PREGUNTA 38:
¿Cuál es el grupo de metales , más importantes provenientes de relaves mineros que contaminan las fuentes naturales de agua y deben ser eliminados en las plantas de tratamiento de agua potable?
A) Na, K, Ca
B) Cu, Ag, Au
C) Zn,Ca,Mg
D) Fe, Ba,Ca
E) As, Pb, Cr
RESOLUCIÓN :
Los relaves mineros son los desechos de la actividad minera que son vertidos en lo ríos lagos , etc . contienen a los metales que al asimilarlos causan daños a los seres vivos :Hg ,Pb,Cd,As ,Cr
Rpta.: "E"
PREGUNTA 39:
Es un elemento químico no metálico sólido de color gris oscuro, tiene alta conductividad eléctrica, se usa como electrodo en las pilas secas, esto corresponde al:
A) Plomo
B) Plata
C) Diamante
D) Grafito
E) Zinc
RESOLUCIÓN :
Las pilas secas como las del control remoto, llevan como electrodo una barrita de grafito
Rpta.: "D"
PREGUNTA 40:
Por la cantidad de soluto, las soluciones se clasifican en:
I) Solución sobresaturada
II) Solución sólida
III) Solución diluida
IV) Solución concentrada
V) Solución electrolítica
A) I, II y III
B) I, III y V
C) II, III y IV
D) I, III y IV
E) III, IV y V
RESOLUCIÓN :
En función a la cantidad de soluto, las soluciones se clasifican en: diluidas, concentradas y sobresaturadas.
Rpta.: "D"
PREGUNTA 41:
Indique a que función química pertenece la siguiente estructura:
CH3 – COO – CH2 – CH3
A) Éter
B) Éster
C) Ácido carboxílico
D) Cetona
E) Amida
RESOLUCIÓN :
El grupo orgánico -COO- corresponde a la función Éster
Rpta.: "B"
PREGUNTA 42:
La estructura corresponde a un (a)
A) Ácido carboxílico
B) Aldehído
C) Éter
D) Cetona
E) Alcohol
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 43:
El ácido cítrico se emplea en pequeñas cantidades como parte de los fertilizantes agrícolas. De acuerdo con la estructura, es correcto afirmar que los grupos funcionales presentes en una molécula de ácido cítrico son:
A) Alcohol y ácido carboxílico.
B) Aldehído y alqueno
C) Cetona y aldehído
D) Alcohol y éster
E) Cetona y éster.
RESOLUCIÓN :
El ácido cítrico en su fórmula presenta −𝐶𝑂𝑂𝐻 y −𝑂𝐻. Los cuales corresponden a los grupos funcionales hidroxilo y carboxilo, el cual es característico de las funciones alcohol y ácido.
Rpta. : "A"
PREGUNTA 44:
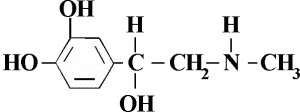
La siguiente estructura es la representación de la molécula de adrenalina. De acuerdo con esta, se puede establecer que las funciones orgánicas presentes en la adrenalina son:
A) Fenol, alcohol y amina.
B) Alqueno, alcano, alcohol y amida.
C) Cicloalcano, alqueno y amida.
D) Fenol, alcohol, amina y éster.
E) Amida, alcohol y éster.
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 45:
Identifica el compuesto químico que precipita con las lluvias ácidas, causando daño a los ecosistemas.
a) Ácido clorhídrico
b) Ácido carbónico
c) Ácido cítrico
d) Ácido acético
e) Ácido nítrico
Rpta.: "E"
PREGUNTA 46:
Determina, cuál de las siguientes proposiciones es incorrecta.
a) El plomo ataca la piel
b) En el smog uno de los componentes es el NO2.
c) El anhídrido carbónico es un gas con efecto invernadero.
d) El monóxido de carbono es venenoso en la respiración.
e) El ácido sulfúrico es parte de la lluvia ácida.
Rpta.: "A"
PREGUNTA 47:
Identifica las moléculas que intervienen en la lluvia ácida y el efecto invernadero, respectivamente:
a) Anhídrido sulfuroso, monóxido de carbono
b) Anhídrido cloroso, anhídrido fosfórico
c) Anhídrido carbónico, anhídrido sulfuroso
d) Anhídrido sulfúrico, anhídrido carbónico
e) Anhídrido sulfúrico, monóxido de carbono
Rpta.: "D"
PREGUNTA 48:
Indica la(s) proposición(es) verdadera(s) referidas a las sustancias químicas:
I) Los gases nobles se ubican en el grupo VII-A de la tabla periódica.
II) Tanto el azufre y el teluro, como el selenio y oxígeno son los elementos calcoides.
III) Los metales alcalinos son más activos químicamente que los metales alcalino – térreos por lo que están ubicados más a la izquierda de la tabla periódica.
IV) Las familias de elementos químicos representativos se ubican en los grupos tipo ¨B¨ de la tabla periódica.
a) II y III
b) I y IV
c) Solo II
d) Solo I
e) Solo III
Rpta.: "E"
PREGUNTA 49:
Determina el tipo de enlace que existe en un cristal de cloruro de sodio (NaCℓ) y en una molécula de propano (C3H8) respectivamente.
a) Covalente y metálico
b) Covalente e iónico
c) Iónico y covalente
d) Iónico y metálico
e) Metálico e iónico
Rpta.: "C"
PREGUNTA 50:
La desintegración de una porción de masa de la materia da lugar a la liberación de 45×1019 ergios de energía. Determina el porcentaje que pasó a ser energía, si la masa inicial fue de 5 gramos.
a) 20 %
b) 25%
c) 35 %
d) 10 %
e) 5 %
RESOLUCIÓN :
Rpta.: "D"
PREGUNTA 51:
El último electrón de la configuración de un átomo tiene los siguientes números cuánticos:
n=4; ℓ=2 ; m=0 y s=–1/2
Determina cuántas partículas tiene dicho átomo.
a) 46
b) 64
c) 45
d) 36
e) 40
RESOLUCIÓN :
Rpta.: "A"
PREGUNTA 52:
Determina la alternativa que corresponde a la fórmula global del compuesto:
2 – cloro – 1 – penten – 3 – ino
a) CH2 = CCℓ – C ≡ C – CH3
b) CH3 CH2 – CHCℓ – CH2 – CH3
c) CH2 = CH – C ≡ C – CH3
d) CH3 – CH = CCℓ – C = CH
e) CHCℓ = CH – C ≡ C – CH3
RESOLUCIÓN :
Rpta.: "A"